FACULTAD DE CIENCIAS MÉDICAS.
Revista Médica Electrónica. 2002; 24(2).
Hantavirosis. Situación de las Américas hasta el año 2001.
Hantavirosis.Situation in the American until the year 2001.
AUTORES
Dra. Regina Yamilet Sosa Díaz, MsC. (1 )
Dra. Ana Gloria Montenegro. (1)
Dra. Janice Sosa Díaz. (2)(1)Especialistas de I Grado en Microbiología.Profesoras Instructoras (1)
(2) Residente de Medicina General Integral (2)RESUMEN
A nivel mundial en los últimos años se asiste al surgimiento de nuevas enfermedades infecciosas conocidas como enfermedades emergentes, producidas en algunos casos por nuevos agentes etiológicos y, en otros, no son más que nuevas presentaciones clínicas producidas por variantes de microorganismos ya conocidos.
Dentro del ya amplio grupo de enfermedades emergentes existentes en el mundo, las producidas por Hantavirus han despertado especial interés. En las Américas la mortal enfermedad se ha presentado en varios países, lo que ha puesto en alerta a las autoridades sanitarias del continente que temen se convierta en una epidemia.
El virus Hanta vive en el ratón silvestre (ratones de cola larga). Al transmitirse al hombre produce una enfermedad que puede ser mortal. Está presente en casi todos los países del mundo. En las Américas produce un síndrome febril con insuficiencia respiratoria, que ha provocado la muerte de cerca del 50 % de los infectados.
Aún no se cuenta con una vacuna efectiva ni existe tratamiento curativo para esta enfermedad, adquiriendo cada vez mayor importancia la Vigilancia Epidemiológica. Mientras más rápido se reciba atención médica, mayor es la posibilidad de recuperación.
Teniendo en cuenta lo expuesto anteriormente, decidimos realizar una compilación de los datos y conocimientos epidemiológicos que hasta la fecha se tienen sobre el Síndrome Pulmonar por Hantavirus (SPH).DESCRIPTORES(DeCS
SÍNDROME PULMONAR POR HANTAVIRUS /epidemiología
HUMANO-ADULTOINTRODUCCIÓN
El género Hantavirus pertenece a la familia Bunyaviridae y ha sido denominado de esta manera por haberse reconocido por primera vez a orillas del río Hantang al presentarse más de 3'000 casos de Fiebre Hemorrágica en las tropas norteamericanas durante la guerra de Corea en 1951. (1, 2)
Se reconocen dos grupos de Hantavirus según sus presentaciones clínicas: los Hantavirus del Viejo mundo, predominantes en Asia y Europa; y los del Nuevo Mundo, predominantes en América. En la Tabla 1 se muestran las especies aisladas hasta la fecha. (1-10)
Los primeros pueden presentarse como dos formas clínicas diferentes: Fiebre Hemorrágica con Síndrome Renal (FHSR) y Nefropatía Epidémica (NE), las cuales son responsables de unos 100'000 casos anuales fundamentalmente en Asia, sobre todo en China y Corea, aunque también se han detectado en Europa en países como Alemania, Francia, Bélgica, Holanda y Rusia. Las alteraciones hematológicas y renales de esta entidad son de intensidad variable según los brotes y los virus involucrados, presentando una mortalidad que oscila entre el 1 y el 15 % (1-9).
Los segundos fueron reconocidos por primera vez en mayo de 1993 en la región de Cuatro Esquinas, al sudoeste de Estados Unidos (E.E.UU.), donde se juntan los estados de Nuevo México, Arizona, Colorado y Utah, afectando en particular a la población de indios navajos habitantes de esa zona. (10-12)
En este sitio se realizó el primer diagnóstico de un brote de enfermedad febril asociada con insuficiencia respiratoria aguda, shock y una mortalidad del 60 al 80 %. Su agente etiológico, en principio desconocido, fue identificado más tarde como una nueva especie de Hantavirus, denominada inicialmente Virus sin Nombre, o Convict Creek o Virus del Cañón del Muerto y que hoy se conoce con el nombre de Four Corners (FC) Hantavirus. Se denominó a esta nueva presentación: Síndrome Pulmonar por Hantavirus (SPH). (11 y 12)Tabla No. 1
Hantavirus reconocidos hasta la fecha.
Virus
Reservorio
Distribución
Enfermedad
Hantaan
A. agrarius
Centro y Este de Asia y Europa
FHSR
Seoul
R. norvegicus
Mundial
FHSR
Thai
B. indica
Sudeste de Asia y La India
Desconocida
Dobrava/Belgrade
A. flavicollis
Asia Menor, Europa y Palestina
FHSR
Puumala
C. glareolus
Rusia, Europa y Asia Menor
FHSR/NE
Khabarovsk
M. fortis
Rusia (región trans Baikal-Amur) y este de China
Desconocida
Thottapalayam
S. murinus
África, India y Sudeste de Asia
Desconocida
Tula
M. arvalis
Rusia, Europa y Asia Menor
Desconocida
Prospect Hill
M. pennsylvanicus
Nordeste de los EE.UU., Canadá y Alaska
Desconocida
Four Corners o Virus sin nombre
P. maniculatus (forma de pradera)
Oeste y Centro de EE.UU. y Canadá
SPH
El Moro Canyon
R. megalotis
Oeste de EE.UU., México y Sudoeste de Canadá
Desconocida
Río Segundo
R. mexicanus
México, Costa Rica y Ecuador
Desconocida
Black Creek Canal
S. hispidus (forma de este)
Sudeste de EE.UU. hasta El Perú
SPH
Bloodland Lake
M. ochrogaster
Medio oeste de EE.UU. y Sur de Canadá
Desconocida
Isla Vista
M. californicus
California, Oregón y México
Desconocida
New York
P. leucopus (Haplotipo Este)
Nordeste de EE.UU y Sudeste de Canadá
SPH
Bayou
O. palustris
Sudoeste de EE.UU.
SPH
Monongahela
P. maniculatus (forma de bosque)
Este de EE.UU. y Canadá
SPH
Blue River
P. leucopus (haplotipo SW/NW)
Centro de EE.UU.
Desconocida
Muleshoe
S. hispidus (forma del oeste)
Sur de EE.UU.
Desconocida
Caño Delgadito
S. alstoni
Venezuela
Desconocida
Andes
O. longicaudatus
Argentina y Chile
SPH
Oran
O. longicaudatus
Noroeste de Argentina
SPH
Lechiguanas
O. flavescens
Centro de Argentina
SPH
Bermejo
O. chacoensis
Noroeste de Argentina
Desconocida
Hu39694
Desconocido
Centro de Argentina
SPH
Pergamino
A. azarae
Centro de Argentina
Desconocida
Maciel
B. obscurus
Centro de Argentina
Desconocida
Laguna Negra
C. laucha
Paraguay y Bolivia
SPH
Juquitiba
Desconocido
Brasil
SPH
Río Mamoré
O. microtis
Bolivia y Perú
Desconocida
Prospect Hill-like
M. Pennsyl/montanus
EE.UU. y Canadá
Desconocida
FRS: Fiebre Hemorrágica con Síndrome Renal.
NE: Nefropatía Epidémica.
SPH: Síndrome Pulmonar por Hantavirus.
EE.UU.: Estados Unidos.
A pesar de haber sido identificado recientemente, el SPH no es una enfermedad nueva, de hecho se ha confirmado la infección por virus FC en una persona que desarrolló una enfermedad compatible con SPH en el año 1959 en los EE.UU. (13)
Comenzó así el estudio de los Hantavirus en América. Para el año 1995, se habían identificado más de 100 casos a lo largo de 26 estados de los EE.UU. y se reconocieron los primeros brotes en Chile y Argentina. (10-15)
Ese mismo año se describe una nueva especie de Hantavirus en Argentina denominada Andes, que en 1996 produce un gran brote de SPH, aportando por primera vez evidencia epidemiológica de transmisión persona a persona. (16,17)
Hasta la fecha, en EE.UU. se han confirmado 283 casos desde 1993 con una mortalidad que oscila entre el 40 y 60 %. Probablemente el descenso de la mortalidad se deba al mayor conocimiento que se posee actualmente acerca de esta enfermedad (12 y 13).
El virus ha sido clasificado como una Robovirosis, teniendo en cuenta su transmisión por el contacto estrecho entre el hombre y el huésped enzoótico, que en este caso, por supuesto, es un roedor (ratones de cola larga) (8, 18 - 21).
Los Hantavirus poseen una forma oval o esférica de 80-120 mm de diámetro. Son virus envueltos, con cápside helicoidal, cuyo genoma es RNA monocatenario de polaridad negativa, trisegmentado y circular, su replicación es citoplasmática (8).
Los Hantavirus del Viejo Mundo incluyen especies como Hantaan (HTN), Puumala (PUU), Seoul (SEO), Prospect Hill (PH), Dobrava-Belgrade (DOB), Khabarovsk (KHB), entre otros; de la misma forma, en el Nuevo Mundo se han identificado una gran cantidad de especies en dependencia del área geográfica y el reservorio, dentro de los cuales se citan Four Corners (FC), Andes (AND), Black Creek Canal (BCC), New York (NY), Bayou (BAY), entre otros (Figura 1) (1-12)
Genéricamente se plantea que el ratón de cola larga asintomático, excretando orina, saliva y heces fecales infectadas, es capaz de transmitir el virus al hombre susceptible que, al infectarse, desarrolla una de las formas clínicas de la enfermedad, produciendose un SPH (Figura 2), una FHSR o una NE. (22 - 27)
Se le ha dado especial importancia a la transmisión por aerosoles provenientes de secreciones infestadas y, sobre todo, en los últimos reportes, se habla sobre la “posible transmisión de persona a persona” reportada en Argentina. (16,17)
Se sugiere un mecanismo de patogenicidad relacionado al aumento de la permeabilidad vascular, con el consiguiente edema pulmonar, generando un cuadro clínico similar al conocido como Síndrome de Distress Respiratorio del Adulto. Se produce así Insuficiencia Respiratoria, lo que conduce, en sus etapas finales, a falla cardiovascular con shock cardiogénico y muerte. (8, 12, 28,29)Figura 2: Patogenia del ISPH
El diagnóstico del SPH es clínico, radiológico y microbiológico. Así, la enfermedad se presenta con un período de incubación de 7 a 14 días. En un inicio, el paciente aqueja síntomas generales como fiebre, mialgias, escalofríos, náuseas, vómitos, diarreas, cefalea y toma del estado general. En ocasiones se presenta respiración ruidosa, vértigo, artralgias, dolor precordial, abdominal y lumbar, sudoración y tos. Puede producirse inyección conjuntival, petequias, taquicardias, disnea y estertores crepitantes. Al aparecer el período de estado de la enfermedad, las complicaciones cardiorrespiratorias son inminentes, se presenta disnea, hipoventilación, severa inestabilidad hemodinámica y shock con una duración de 7 a 10 días; ésta es una etapa crítica para el paciente, con alto índice de mortalidad. La convalecencia sólo se logra si se superan las etapas anteriores (8, 10, 12, 28-30). Los exámenes de laboratorio clínico arrojan leucocitosis con desviación a la izquierda, neutrofilia con formas inmaduras circulantes (metamielocitos), linfocitos atípicos en sangre periférica, hematocrito aumentado y trombocitopenia, deshidrogenasa láctica y transaminasas elevadas, proteínas totales disminuidas. (10, 12, 28,30)
La radiografía de tórax revela en forma temprana infiltrados bilaterales simétricos intersticiales que pueden mostrar patrones de líquido intralveolar. Estas imágenes son compatibles con las del Distress Respiratorio del Adulto (10, 12, 28,30). Para hacer el diagnóstico de microbiología, la muestra por excelencia es sangre o suero. El aislamiento es ineficiente y potencialmente peligroso para los trabajadores del laboratorio (31). La propagación en cultivos celulares aún no está clara. Se cuenta con dos técnicas serológicas: un ELISA de microcaptura tipo sandwish que utiliza la proteína N recombinante como antígeno blanco para detectar anticuerpos IgG y 2 tipos de Western Blot confirmatorios que utilizan diferentes antígenos para comprobar la existencia de anticuerpos IgM e IgG. (10, 12, 28, 30)
Pruebas de biología molecular como la RT-PCR y la secuenciación de ácidos nucleicos han permitido conocer particularidades genéticas de los Hantavirus aislados de diferentes roedores reservorios, según su ubicación geográfica. (11, 16, 20, 26, 32-37)
Desde el punto de vista epidemiológico, los Hantavirus se distribuyen mundialmente. En las Américas, el virus ya se ha reportado en 31 estados de los EE.UU. (Figura 3) y en países como Canadá, Argentina, Chile, Brasil, Uruguay, Paraguay, Bolivia y Panamá. (21, 23, 24, 26, 28, 33, 38-41)
Los roedores de cola larga constituyen el reservorio por excelencia de los Hantavirus (Figura 4), aunque se estudia el posible contagio a través de otros tipos de roedores. El g énero hantavirus es el único de la Familia Bunyaviridae que no se transmite a través de mosquitos, moscas u otros artrópodos. Se considera una Robovirosis. Entre los roedores el virus se transmite por vía horizontal. (21-24, 26, 33, 38-43)
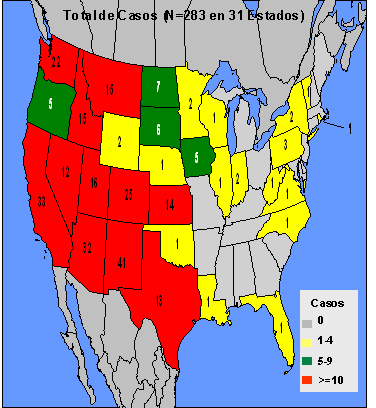

Fig. 3: Distribución de casos de SPH en los EE.UU
hasta el 16 de Abril del año 2001. CDC de Atlanta.Fig. 4: Peromyscus maniculatus, reservorio del virus Four Corners .
La mortalidad en inicios alcanzó del 80-90 %. Actualmente está alrededor del 60 % debido a que la enfermedad se conoce y se espera. (8, 10, 12, 23, 24, 26, 28-30)
La transmisión de la enfermedad se produce por la aspiración de aerosoles a partir de saliva, orina y materias fecales de roedores infectados (22-27). El contagio interhumano ha sido “descrito” en Argentina (16,17). Se comunica la posibilidad de transmisión a través de heridas y mordeduras por ratones infectados. (24, 27)
Todas las edades, sexos y razas son susceptibles, aunque existen grupos de mayor riesgo como trabajadores de la agricultura, forestales y aserradores, trabajadores portuarios, desratizadores, escolares de establecimientos rurales o suburbanos, personas que acampan al aire libre o en zonas de campismo, personas que se alojan en albergues, cabañas o lugares que han permanecido cerrados. (8, 10, 12, 23, 24, 26, 28-30)
Hasta la fecha no existe una vacuna efectiva, aunque se realizan esfuerzos para lograrla. En el laboratorio de referencia para el diagnóstico de infecciones por Hantavirus en humanos y animales de la Universidad de Nuevo México, Alburquerque, EE.UU., el Dr. Hjelle et al., se encuentran realizando estudios para desarrollar una estrategia vacunal innovadora contra el HPS y otras enfermedades virales emergentes (44). Debido a la ausencia de la vacuna se le atribuye gran importancia a las medidas de prevención conductuales dirigidas a los grupos de riesgo y al control de la población de roedores. (8, 10, 12, 23, 24, 26, 28-30)
No existe un tratamiento específico para la enfermedad, la conducta a seguir se basa en la aplicación de medidas generales como el ingreso en Unidad de Cuidados Intensivos (UCI); evitar hipoxia, especialmente durante el traslado a la UCI; ventilación asistida temprana; monitoreo cuidadoso de la oxigenación, del balance de líquidos y de la tensión arterial; uso de agentes ionotrópicos y manejo cuidadoso de la reposición hídrica empleando fundamentalmente plasma. Con respecto a la utilización de antivirales, se han realizado estudios con ribavirina con resultados hasta el momento no concluyentes. (28, 30)CONCLUSIONES
Las enfermedades emergentes, que han invadido a la humanidad durante los últimos años, han ido cobrando importancia sobre todo en el mundo científico; el SPH no se excluye de esta agrupación.
Las enfermedades emergentes aparecen por sus casos fatales. A medida que se incremente el conocimiento sobre las mismas se pasará de lo sensacionalista y afectivo a lo racional y mesurado, en este sentido nos daremos cuenta que el SPH no es 100 % letal y centraremos nuestra atención en el eje angular del problema. “La Vigilancia Epidemiológica”, sobre la cual recae el peso de la contención de la enfermedad en territorios ya invadidos y de la prevención en aquéllos que, como el nuestro, todavía son vírgenes de esta virosis; si tenemos en cuenta la imposibilidad de prevención mediante una vacuna inexistente hasta el momento, entonces la vigilancia cobra aún mayor importancia.
Las intervenciones humanas, alterando ecosistemas y aumentando el contacto entre roedores y hombres, así como los cambios estacionales debidos a eventos climáticos, son dos de los factores ecológicos que más se invocan en la emergencia de esta enfermedad.
Afortunadamente, en Cuba no se han reportado casos de SPH. Teniendo en cuenta el origen incipiente de esta enfermedad consideramos que el objetivo central de la vigilancia en nuestro territorio es la información, que debe ser difundida a todo el personal de la Salud para incrementar los conocimientos sobre el SPH.
Ésta es la forma más inteligente de enfrentar la amenaza de invasión no sólo de los Hantavirus, sino de todos los agentes infecciosos causantes de enfermedades, hasta el momento, desconocidas o poco conocidas.
La Vigilancia Epidemiológica es el arma más eficaz con que cuenta el hombre para su supervivencia en la batalla contra el enemigo más potente de la humanidad: las enfermedades.REFERENCIAS BIBLIOGRÁFICAS
- Gajdusek D. Virus hemorrhagic fevers. J Pediatr; 1962;60:841-57.
- Smadel J. Epidemic hemorrhagic fever. Am J Public Health; 1953;43:1327-30.
- World Health Organization. Haemorrhagic fever with renal syndrome: memorandum from a WHO meeting. Bull World Health Organ; 1983;61:269-75.
- Gajdusek DC, Goldfarb LG, Goldgaber D. Bibliography of hemorrhagic fever with renal syndrome. Second Edition. Bethesda (MD): National Institutes of Health; 1987 Pub No. 88-3603.
- Plyusnin A, Nemirov K, Apekina N, et al. Dobrava Hantavirus in Russia. Lancet; 1999; 353:207.
- Lee H, Lee P, Johnson K. Isolation of the etiologic agent of Korean hemorrhagic fever. J Infect Dis; 1978;137:298-308.
- Nemirov K, Vapalahti O, Lundkvist A, et al. Isolation and characterization of Dobrava hantavirus in the stripped field mouse (Apodemus agrarius) in Estonia . J Gen Virol; 1999; 80:371-9
- Mertz GJ, Hjelle BL, Bryan RT. Hantavirus Infection. Adv Intern Med; 1997; 42:369-421.
- Yashina L, Mishin V, Schmaljohn C, et al. A newly Discovered Variant of a Hantavirus in Apodemus peninsulae, far Eastern Russia . Emerg Infect Dis; 2001; 7:5.
- Ksiazek TG, Peters CJ, Rollin PE, Zaki S, Nichol S, Spiropoulou C, et al. Identification of a new North American hantavirus that causes acute pulmonary insufficiency. Am J Trop Med Hyg; 1995;52:117-23.
- Nichol ST, Spiropoulou CF, Morzunov S. Genetic identification of a hantavirus associated with an outbreak of acute respiratory illness. Science; 1993;262:914-7.
- Duchin JS, Koster FT, Peters CJ, Simpson GL, Tempest B, Zaki SR, et al. Hantavirus pulmonary syndrome: a clinical description of 17 patients with a newly recognized disease. N Engl J Med; 1994;330:949-55.
- Centers for Disease Control and Prevention. Case Definition for Infectious Conditions Under Public Health Surveillance in Morbidity and Mortality Weekly Report, May 02, 1997/Vol 46, No RR10;1.
- Rhodes LV, Huang C, Sánchez AJ. Hantavirus Pulmonary Syndrome Associated with Monongahela Virus, Pennsylvania. Emerg Infect Dis; 2000; 6:8.
- Khan AS, Spiropoulou CF, Morzunov S, Zaki SR, Kohn MA, Nawas SR, et al. Fatal illness associated with a new hantavirus in Louisiana. J Med Virol; 1995;46:281-6.
- Padula PJ, Edelstein A, Miguel SDL, López NM, Rossi CM, Rabonovich RD. Hantavirus pulmonary syndrome outbreak in Argentina: Molecular evidence for person-to-person transmission of Andes virus. Virology; 1998; 241:323-30.
- Enria D, Padula P, Segura EL, et al. Hantavirus pulmonary syndrome in Argentina : possibility of person to person transmission. Medicina (B. Aires); 1996;56: 709-11.
- Parmenter R, Vigil R. The Hantavirus epidemic in the southwest: an assessment of autumn rodent densities and population demographics in central and northern New Mexico. Atlanta (GA); 1993 Report to the Federal Centers for Disease Control and Prevention.
- Nerurkar VR, Song JW, Song KJ, Nagle JW, Hjelle B, et al. Genetic evidence for a hantavirus enzootic in deer mice (Peromyscus maniculatus) captured a decade before the recognition of hantavirus pulmonary syndrome. Virology; 1994. 204: 563-8.
- Jay M, Ascher MS, Chomel BB, et al. Sero-epidemiological studies of hantavirus infection among wild rodents in California. Emerg Infect Dis; 1997;3.
- Rowe JE, St Jeor SC, Riolo J, Otteson EW, et al. Coexistence of several novel hantaviruses in rodents indigenous to North America. Virology; 1995;213: 122-30.
- Lee HW. Epidemiology and pathogenesis of hemorrhagic fever with renal syndrome. In: Elliott RM, editor. The Bunyaviridae. New York : Plenum Press; 1996: 253-67.
- Glass G, Childs J, et al. Association of intraspecific wounding with hantaviral infection in wild rats (Rattus norvegicus). Epidemiol Infect; 1988;101: 459-72.
- Dournon E, Moriniere B, Matheron S, Girard P, Gonzalez J, Hirsch F, et al. HFRS after a wild rodent bite in the hautesavoie--and risk of exposure to Hantaan-like virus in Paris laboratory. Lancet; 1984;1: 676-7.
- Armstrong L, Zaki S, Goldoft M, Todd R, Khan A, Khabbaz R, et al. Hantavirus pulmonary syndrome associated with entering or cleaning rarely used, rodent-infested structures. J Infect Dis; 1995;172: 1166.
- Hjelle B, Torrez-Martínez N, Koster FT, Jay M, Ascher MS, Brown T, et al. Epidemiologic linkage of rodent and human hantavirus genomic sequences in case investigations of hantavirus pulmonary syndrome. J Infect Dis; 1996;173: 781-6.
- Jay M, Hjelle B, Davis R, et al. Occupational exposure leading to hantavirus pulmonary syndrome in a utility company employee. Clin Infect Dis; 1996;22: 841-4 .
- Pan American Health Organization. Hantavirus in the Americas : guidelines for diagnosis, treatment, prevention and control. Washington , DC : Pan American Health Organization; 1999: 1-65.
- Hjelle B, Jenison S, Torrez-Martínez N, et al. A novel hantavirus associated with an outbreak of fatal respiratory disease in the southwestern United States : evolutionary relation-ships to known hantaviruses. J Virol; 1994;68: 592-6.
- Mertz G, Hjelle B, Bryan R. Hantavirus infection. In: Fauci A, Schrier R, editors. Advances in internal medicine. Chicago : Mosby Year Book Inc;, 1996: 373-425.
- Rotz LD, Khan AS , Scott R, et al. Public Health Assesment of Potential Biological Terrorism Agents. Emerg Infec Dis February; 2002. 8:2.
- Hjelle B, Anderson B, Torrez-Martínez N, Song W, Gannon WF, L. YT. Prevalence and geographic genetic variation of hantaviruses of New World harvest mice (Reithrodontomys): identification of a divergent genotype from a Costa Rican Reithrodontomys mexicanus. Virology; 1995;207:452-9.
- Xiao SY, Leduc JW, Chu YK, Schmaljohn CS. Phylo-genetic analyses of virus isolates in the genus Hantavirus, family Bunyaviridae. Virology 1994;198: 205-17.
- Li D, Schmaljohn A, Anderson K, Schmaljohn C. Complete nucleotide sequences of the M and S segments of two hantavirus isolates from California: evidence for reassortment in nature among viruses related to hantavirus pulmonary syndrome. Virology; 1995;206: 973-83.
- Spiropoulou CF, Morzunov S, Feldmann H, et al. Genome structure and variability of a virus causing hantavirus pulmonary syndrome. Virology; 1994;200: 715-23.
- Ravkov EV, Rollin PE, Ksiazek TG, Peters CJ, Nichol ST. Genetic and serologic analysis of Black Creek Canal virus and its association with human disease and Sigmodon hispidus infection. Virology; 1995;210: 482-9.
- Torrez-Martínez N, Song W, Hjelle B. Nucleotide sequence analysis of the M genomic segment of El Moro Canyon hantavirus: antigenic distinction from Four Corners hantavirus. Virology; 1995; 211: 336-8.
- Monroe MC, Morzunov SP, Johnson AM, et al. Genetic diversity and distribution of Peromyscus-borne hantaviruses in North America. Emerg Infect Dis; 1999; 5: 75-86.
- Calisher CH, Sweeney W, Mills JN, Beaty BJ. Natural history of Sin Nombre virus in western Colorado. Emerg Infect Dis; 1999; 5: 126-34.
- Vincent MJ, Quiroz E, Gracia F, Sánchez AJ, Ksiazek TG, Kitsutani PT, et al. Hantavirus pulmonary syndrome in Panama : identification of novel hantaviruses and their likely reservoirs. Virology; 2000: 277:9-14.
- Calisher CH, Blair CD, Bowen MD, et al. Identification of arboviruses and certain Rodents-Borne Viruses: Reevaluation of the Paradigm. Emerg Infect Dis; 2001. 7:4.
- M ills JN, Ksiazek TG, Peters CJ, Childs JE. Long-term studies of hantavirus reservoir populations in the southwestern United States : a synthesis. Emerg Infect Dis; 1999;5: 135-42.
- Abbott KD, Ksiazek TG, Mills JN. Long-term hantavirus persistence in rodent populations in central Arizona . Emerg Infect Dis; 1999;5: 102-12.
- Schmaljohn C, Hjelle B. Hantaviruses: A Global Disease Problem. Emerg Infect Dis; 1997;3: 95-104.
SUMMARY
During the last years and throughout the world we have faced the onset of new infectious diseases known as emergent diseases (ED); which in some cases are caused by new etiological agents. In other cases they are just new clinical presentations originated by variants of micro–organisms which are already known.
Inside the wide group of ED, the ones produced by the Hantavirus have been of a special interest. In America the mortal disease has disseminated to several countries which has called the health authorities of the continent to a serious alert situation; since they fear it becomes an epidemic.
The Hantavirus lives in the wild mouse (long tail mice). When transmitted to the man it produces a disease that can be mortal. It exists in almost all the countries around the world.
In America it causes a syndromic fever accompanied by a respiratory insufficiency which has resulted in death in 50% of the infected people.
There isn't an effective vaccine yet; neither exists the cure for this disease, this is why the epidemiological surveillance acquires more and more importance.
The sooner the medical attention is received, the bigger will be the possibility of overcoming the disease. Taking into account the already exposed arguments; we have decided to make a compilation of the data and the epidemiological knowledge which exist up to date about the Lung Syndrome by Hantavirus (LSH).CÓMO CITAR ESTE ARTÍCULO
Sosa Díaz R Y,A G Montenegro, Sosa Díaz J.Hantavirosis. Situación de las Américas hasta el año 2001.Rev méd electrón[Seriada en línea] 2002; 24(2).. Disponible en URL:http://www.revmatanzas.sld.cu/revista medica/año2002/tema4.htm[consulta: fecha de acceso]
Enlaces refback
- No hay ningún enlace refback.




